6. DIAGNOSI
6.1. Rilevamento delle microfilarie
6.1.1. Modalità di prelievo
L'osservazione delle microfilarie nel sangue circolante di un cane rappresenta
un aspetto diagnostico fondamentale che supporta la presenza di macrofilarie
mature (Rawlings e Calvert, 1995).
Le tecniche per la ricerca e l'identificazione delle microfilarie non
garantiscono la diagnosi, in quanto possono dare risultati falsamente
negativi oltre che nella filariosi occulta anche nei casi in cui la microfilariemia,
pur presente, è modica e per variazioni che si verificano nel numero
di microfilarie nel sangue periferico (Knight, 1995).
L'incostante presenza nel torrente circolatorio periferico delle microfilarie
rende opportuno seguire alcuni accorgimenti nella scelta del momento del
prelievo. Le larve seguono, infatti, ritmi circadiani, con una presenza
più elevata nella microcircolazione periferica nelle ore serali
e notturne. Questi accorgimenti hanno valore specialmente se viene impiegato
il metodo di rilevamento su sangue fresco, a goccia spessa, mentre invece
non sono necessari se vengono impiegati metodi di rilevamento con arricchimento
(Traldi, 1987).
Dal punto di vista strettamente tecnico, il prelievo di sangue può
essere effettuato dalla vena cefalica dell'avambraccio o, più raramente,
dalla vena safena esterna per effettuare sia esami a fresco sia tecniche
di arricchimento e di identificazione.
6.1.2. Esame a fresco a goccia spessa
Prima di eseguire un test di concentrazione per le microfilarie, è
fondamentale effettuare uno striscio ematico per la visualizzazione diretta
delle larve (Knight, 1995).
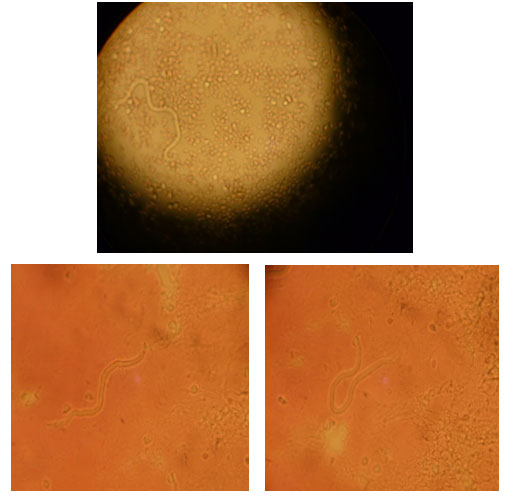
Una goccia di sangue è posta su un vetrino portaoggetto e coperta
con il coprioggetto. L'osservazione microscopica a 100 ingrandimenti permette
di evidenziare lo spostamento degli eritrociti causato dal movimento delle
microfilarie e di visualizzare le microfilarie stesse, qualora presenti
(Fotografia 3).
L'esame microscopico dello striscio ematico, quando negativo, non è
indicativo dell'assenza dell'infestazione da parte del parassita sia per
la presenza della filariosi occulta sia perché tale esame rappresenta
un mezzo d'indagine significativamente meno sensibile del test di concentrazione
(Rawlings e Calvert, 1995).
Questa tecnica, semplice e di rapida attuazione, pur rappresentando un
preliminare approccio al problema diagnostico, non consente di differenziare
le specie di microfilarie eventualmente presenti. È necessario
pertanto ricorrere a tecniche specifiche, dal momento che solo D. immitis
ha una localizzazione cardiaca, e le sue larve riconducono a macrofilarie.
 |
6.1.3. Tipizzazione su base morfologica
Concentrazione e colorazione delle microfilarie secondo la tecnica
di Knott modificata
Rawlings, nel 1986, riportò un metodo di Knott modificato, più
rapido rispetto al precedente, che consiste nella centrifugazione per
3-5 minuti a 1500 rpm di una provetta conica contenente 1 ml di sangue
venoso e 10 ml di formalina tamponata al 2%, previa agitazione della stessa
per favorire la lisi degli eritrociti. Allontanato il surnatante, si aggiungono
al sedimento un paio di gocce di soluzione acquosa 1:1000 di blu di metilene.
Si preleva il sedimento e, dopo averlo deposto su un vetrino portaoggetto,
si copre con un vetrino coprioggetto che è così pronto per
essere osservato al microscopio con evidenziazione delle microfilarie
a 100 ingrandimenti ed identificazione a 400 ingrandimenti (Rawlings,
1986).
Concentrazione mediante filtrazione
In una siringa, contenente 1 ml di sangue, si aspirano 9 ml di una soluzione
lisante (saponina al 2% o acqua distillata). Dopo aver raccordato la siringa
al portafiltro, contenente un filtro in policarbonato, vi si inietta il
liquido con le cellule lisate. Si risciacqua il filtro con acqua di fonte.
La membrana filtrante viene estratta ed appoggiata su un vetrino, con
il lato contenente il filtrato rivolto verso l'alto, per essere colorata
con 1 o 2 gocce di soluzione acquosa di blu di metilene all'1%. Si esamina
il filtro al microscopio a 100 ingrandimenti: le larve appaiono moderatamente
colorate in blu e immobili (Wyle, 1970).
Identificazione delle microfilarie circolanti
Le due tecniche di concentrazione descritte possono essere allestite,
a seconda delle esigenze, con sangue fresco o conservato con l'aggiunta
di anticoagulante. Il citrato di sodio è l'anticoagulante di scelta
poiché non altera le microfilarie e le conserva a lungo vitali.
Viceversa, altre sostanze provocano l'agglutinazione delle microfilarie
(eparina) o la morte (rapida il fluoruro di sodio o ossalato; in 48 ore
l'EDTA).
Le microfilarie, ottenute tramite queste metodiche, possono essere caratterizzate
morfologicamente previa colorazione per facilitarne l'evidenziazione al
microscopio. Il blu di metilene è il colorante più adatto
e, sebbene non sia in grado di penetrare uniformemente nei tessuti delle
microfilarie e visualizzare completamente le strutture interne, consente
di rilevarne i caratteri morfologici fondamentali per l'identificazione
senza modificarle (Venco et al., 1998).
Entrambe le tecniche hanno un'accuratezza diagnostica paragonabile (Masi,
1987) e sebbene il test di filtrazione sia di più semplice esecuzione,
la tipizzazione delle microfilarie risulta più facile utilizzando
il test di Knott.
La tipizzazione delle microfilarie è una tappa importante nella
diagnosi della filariosi cardiopolmonare del cane in quanto nel sangue
periferico potrebbero esservi anche microfilarie appartenenti a specie
di larve differenti da D. immitis.
In Italia la maggior parte dei soggetti infestati da filaridi presenta
microfilarie riconducibili ad almeno due specie di filarie: D. immitis
e D. repens.
Dip. reconditum e Dip. grassi possono essere riscontrate nel cane occasionalmente,
mentre Dip. dracunculoides, osservato inizialmente solo nelle volpi (Marconcini
e Macchioni 1980), è stato segnalato anche nel cane in Portogalllo
e in Spagna (Rojo-Vasquez et al., 1990).
I caratteri morfologici principali che consentono di identificare le microfilarie
sono la lunghezza complessiva e la forma delle estremità cefalica
e caudale. Le caratteristiche morfometriche delle microfilarie possono
subire variazioni in funzione delle modalità di preparazione delle
stesse. La loro valutazione dovrebbe essere effettuata su microfilarie
in perfetta estensione, fissate in formalina e colorate per via umida
(blu di metilene). Le microfilarie conservate in sangue eparinizzato risultano
più lunghe e quelle concentrate tramite la tecnica di filtrazione
sono più corte o possono presentare modificazioni dell'estremità
caudale in particolare quelle di D. reconditum e D. grassi in cui l'uncino
non risulta più visibile (Manfredi, 1998). Se si vuole effettuare
una misurazione delle microfilarie è necessario l'impiego di un
oculare dotato di scala micrometrica. La misurazione dell'ampiezza dovrebbe
essere sempre eseguita in un punto standard della microfilaria quale potrebbe
essere il poro anale e la misurazione della lunghezza deve comprendere
anche la coda (Traldi et al., 1987).
Come si può osservare nella figura 1 e nella tabella 1 la microfilaria
di D. immitis, si differenzia, oltre che per le dimensioni, per la forma
affusolata della testa e per la coda relativamente dritta.
Figura 1.
A e B: D. immitis: estremità cefalica (x400) e caudale (x1000).
C e D: D. repens: estremità cefalica (x400) e caudale (x1000).
E: Dip. reconditum: estremità cefalica, con l'uncino (x1000).
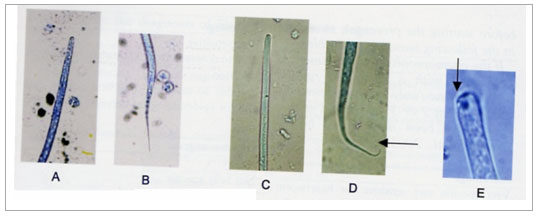
Tabella 1. Caratteristiche morfometriche delle microfilarie isolate con la tecnica di Knott.
|
D. immitis
|
D. repens
|
Dip. reconditum
|
Dip. grassi
|
Dip. dracunculoides
|
|
|
Lunghezza µm
|
290-330
|
300-360
|
260-283
|
567
|
190-247
|
|
Diametro µm
|
5-7
|
6-8
|
4
|
12-25
|
4-6.5
|
|
Estremità cefalica
|
affusolata
|
arrotondata
|
arrotondata
con uncino |
arrotondata
|
arrotondata
|
|
Estremità caudale
|
diritta
|
a manico di ombrello
|
ricurva e terminante spesso ad uncino
|
uncinata
|
diritta e tronca
|
|
Motilità
|
locale caotica senza spostarsi
|
ondulatoria, si spostano dal campo microscopico
|
caotica
|
caotica
|
locale
|
|
Quantità microfilarie
|
media-elevata
|
media-bassa
|
scarsa
|
scarsa
|
scarsa
|
6.1.4. Validità di alcune tecniche ematologiche
Kit diagnostici di sempre più elevato contenuto tecnologico sono
reperibili sul mercato e tendono a sostituire le tradizionali tecniche
diagnostiche.
Martini e colleghi, nel 1990, effettuarono un'indagine sulla FCP comparando
i vari test ematologici, per la ricerca e l'identificazione delle microfilarie,
al fine di stabilire la loro affidabilità e definire una corretta
gerarchia diagnostica. Utilizzando la tecnica di filtrazione (FT) (Dennis
e Kean, 1971) furono esaminati 329 campioni di sangue, prelevati da cani
di un area iperendemica, quale la Valle del Po (Pampiglione et al., 1986;
Genchi et al., 1988; Poglayen et al., 1988). Questa metodica fu presa
come tecnica di riferimento per la sua capacità di rilevare bassi
livelli (1/ml) di microfilariemia ematica (Williams et al., 1977) e di
differenziare le microfilarie di D. immitis da quelle di D. repens. Tutti
i campioni furono controllati anche con uno striscio diretto (DS); 186
campioni con il test di Knott modificato (KT) e 143 con una speciale modificazione
(Cancrini, 1988) di questa tecnica (MKT), realizzata diluendo il sangue
(2 ml) ed estendendo il tempo di centrifugazione (20'). I preparati furono
osservati al microscopio.
Dai risultati emerse che 163 (49,5%), dei 329 campioni di sangue esaminati,
erano positivi al test di riferimento (FT): 160 (98,2%) per D. immitis;
2 (1,2%) per D. repens e 1 (0,6%) per entrambe le specie. A seguito della
bassa prevalenza di D. repens tutti i dati furono riferiti per le elaborazioni
alla D. immitis.
La sensibilità (SE), specificità (SP), valore predittivo
positivo (VPP) e valore predittivo negativo (VPN), furono calcolati per
ogni metodo diagnostico in relazione alla tecnica di filtrazione. La sensibilità
relativa (SE) fu valutata anche per tre diverse classi di microfilariemia
(0-1000; 1001-50000; >50000).
Furono misurati i livelli di concordanza tra il test di riferimento e
le altre tecniche ematologiche quali DS, KT e MKT.
I valori di SE relativa dei tre test comparati risultarono essere ottimali
(circa 90%): 88,3% per DS, 91,0% per KT e 91,8% per MKT. Solo per le classi
con bassi livelli di microfilariemia, i valori di SE relativa erano insufficienti,
soprattutto per quanto riguardava DS e MKT. Per le altre classi di microfilarie
i valori di SE relativa apparivano adeguati, soprattutto se si considera
che questo studio è stato condotto in un area iperendemica.
La comparazione tra i test evidenziò valori di SP relativa eccellenti,
del 100%, con l'eccezione di DS (99,4%), dovuta ad un singolo caso di
positività nel DS e negatività nel FT.
Le tecniche diagnostiche dirette hanno mostrato un'alta validità,
e non devono essere messe in un secondo piano, essendo economiche, pratiche
e facili da interpretare e in questa esperienza hanno presentato eccellenti
performances.
Gli autori hanno proposto un protocollo diagnostico dove lo striscio ematico
diretto è sempre la metodica di prima scelta da utilizzare, seguita
nei casi dubbi dalla filtrazione. In presenza di risultati ematologici
negativi, in un cane con segni clinici riferibili alla filariosi cardiopolmonare,
deve essere effettuato un test diagnostico (Martini et al., 1991).
6.2. Test diagnostici antigenici
Negli ultimi anni si è andato affermando l'uso dei test per la
ricerca degli antigeni di D. immitis presenti nel circolo sanguigno confinando
la ricerca delle microfilarie ad un ruolo subalterno. L'aumentato impiego
di queste tecniche è da ricercare, in parte, nella elevata frequenza
dei soggetti con microfilariemia modesta o addirittura assente (Manfredi,
1998) e nell'uso di programmi di profilassi che tendono alla progressiva
sterilizzazione degli adulti. Sono tutte tecniche accurate e forniscono
nell'insieme una notevole specificità ed una maggiore sensibilità
rispetto ai test per la rilevazione delle microfilarie, consentendo di
svelare la maggior parte delle infestazioni occulte (Rawlings e Calvert,
2003).
I kit usati, utilizzando anticorpi monoclonali, rilevano gli antigeni
delle filarie presenti in circolo, che derivano dall'apparato riproduttivo
delle femmine adulte. L'antigene circolante in genere è rilevabile
entro 6,5-7 mesi dall'infestazione iniziale, rendendo inutile testare
i cuccioli di età inferiore a 6 mesi. Si ottengono costantemente
risultati positivi in presenza di almeno tre femmine adulte. Questi test
sono caratterizzati da una notevole semplicità d'uso, non richiedono
attrezzature particolari o altri reagenti oltre a quelli forniti dal kit
e hanno tempi di esecuzione contenuti, soprattutto quelli che prevedono
l'impiego di sangue intero. La maggior parte dei test, attualmente in
commercio, sono basati sulla tecnica ELISA (Enzime-Linked ImmunoSorbent
Assay), sebbene siano disponibili anche test basati sull'emoagglutinazione
e su metodiche di immunocromatografia (Knight, 1999).
I test ELISA si avvalgono di anticorpi monoclonali specifici nei confronti
di D. immitis, uno dei quali è coniugato all'enzima perossidasi.
La positività del campione è segnalata, all'aggiunta di
un substrato, dalla comparsa di una colorazione nel pozzetto o sulla membrana
di reazione la cui lettura può essere semplicemente visiva o mediante
spettrofotometro (Manfredi, 1998). I test predisposti per la lettura della
reazione colorimetrica allo spettrofotometro o che prevedono la comparsa
di più strisce o più spot colorati per la risposta positiva
consentono di effettuare una valutazione semiquantitativa dell'infestazione,
stimando la carica parassitaria infestante come elevata, oppure bassa.
Come regola, le reazioni rapide e intense indicano la presenza di una
carica parassitaria relativamente alta. La concentrazione degli antigeni
circolanti, e quindi il grado di positività della risposta, è
direttamente proporzionale al numero di parassiti adulti presenti in ambito
cardiocircolatorio. La costante positività nei casi necroscopicamente
accertati di filariosi occulta e l'assenza di reattività crociata
con antigeni derivanti da D. repens lo rendono estremamente attendibile.
Per ciò che concerne i test basati sulla tecnica di immunocromatografia,
in questi l'antigene solubile di D. immitis si lega all'anticorpo specifico
coniugato posto sulla membrana reattiva di nitrocellulosa determinando
la comparsa di una banda colorata. L'intensità della colorazione
varia in relazione alla quantità di antigene presente nel campione.
Se nel campione non c'è l'antigene o comunque la quantità
presente è al di sotto del livello di "sensibilità"
non si forma alcuna banda. Sulla membrana è posto inoltre un anticorpo
specifico non coniugato anti-anticorpo che determina, anche in assenza
di antigene, la comparsa di una seconda banda colorata che costituisce
il controllo positivo del test (Manfredi, 1998).
Elenco di alcuni test per la ricerca degli antigeni di D. immitis commercializzati
in Italia:
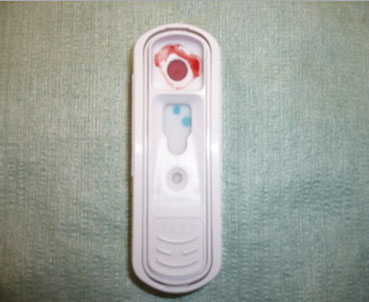
- SNAP® CANINE HEARTWORM. IDEXX. Test da effettuarsi su siero, plasma o sangue intero. Molto semplice da impiegare, accurato e con un ottimo rapporto qualità/prezzo. Utilizza la tecnica ELISA ed è un test semiquantitativo (Fotografia 4 e 5).
- HESKA SOLO STEP® CH. HESKA. Test da effettuarsi su siero, plasma o sangue intero. Ottimo test per accuratezza e costi.
- FILARCHEK®. AGROLABO. Test ELISA, veloce e pratico con ottimo rapporto qualità/prezzo.
- WITNESS® TEST. MERIAL. Test da effettuarsi su siero, plasma o
sangue intero. Utilizza la tecnica dell'immunocromatografia
 |
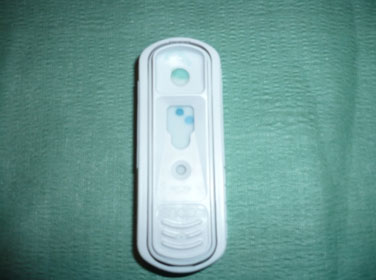
Fotografia 5. Snap IDEXX positivo per filariosi cardiopolmonare, utilizzando siero.
 |
6.2.1. Risultati dei test e loro interpretazione
È importante seguire attentamente le istruzioni dettate dalla
casa produttrice del kit per ottenere risultati accurati.
Quando il test è effettuato secondo le modalità consigliate,
i risultati falsi positivi, dovuti solitamente a errori tecnici, come
insufficiente numero dei lavaggi o mancato rispetto del tempo necessario
per la comparsa del risultato, sono rari (Knight, 1999).
L'utilizzo dei test antigenici può fornire dei risultati falsi
negativi per i motivi sotto esposti (Rawlings e Calvert, 1995).
- Quasi tutte le infestazioni sono diagnosticate dopo 6-7 mesi dal momento dell'inoculazione con le larve infestanti. È inutile effettuare un test antigenico prima di questo periodo (infestazioni sostenute da femmine immature).
- Nel caso in cui non siano presenti dei parassiti di sesso femminile, i vermi maschi non contribuiscono a rendere positivo il risultato del test antigenico.
- Se sono presenti meno di tre filarie di sesso femminile adulte, i risultati dei test possono essere dei falsi negativi.
- Nel gatto la carica parassitaria è bassa ed esiste una maggiore probabilità di infestazioni dovute unicamente a parassiti maschi, in questa specie viene riscontrato un numero maggiore di falsi negativi (3-14% dei casi).
- Un kit non è stato riportato a temperatura ambiente prima dell'uso.
Di seguito sono riportate alcune linee guida per l'interpretazione dei test (Knight, 1999): - I cani che presentano un risultato debolmente positivo con un primo test devono essere ricontrollati ripetendo il test dopo un mese o utilizzandone uno di tipo diverso.
- Un test antigenico positivo deve essere seguito da un test di concentrazione delle microfilarie, per verificarne l'eventuale presenza.
6.2.2. Consigli pratici
I test antigenici per D. immitis dovrebbero essere effettuati annualmente
in tutti i cani che vivono nelle regioni endemiche ed in tutti quei cani
che manifestano dei segni clinici riferibili alla malattia parassitaria.
Nelle aree geografiche caratterizzate da una stagione invernale fredda,
il test si effettua a primavera inoltrata, immediatamente prima dell'inizio
della stagione in cui si verifica la trasmissione del parassita, per rilevare
le infestazioni contratte nell'anno precedente (Rawlings e Calvert, 2003).
Nell'area geografica relativa al bacino idrografico del fiume Po si effettua
il test tra il mese di marzo e di aprile.
Sulla base della situazione epidemiologica attuale, la diagnosi di laboratorio
della filariosi cardiopolmonare dovrebbe essere effettuata mediante la
ricerca contemporanea degli antigeni e delle microfilarie. Quest'ultima
è indispensabile per la conferma soprattutto delle infestazioni
miste (D. immitis e D. repens). Per altro, l'accertamento della microfilariemia
con il test di Knott è di importanza rilevante se si tiene conto
anche della patogenicità delle microfilarie circolanti (Manfredi,
1998).
È importante sottolineare alcuni concetti:
- la scelta di una metodica piuttosto di un'altra deve sempre tener conto della accuratezza, sensibilità e specificità della stessa;
- quando i test antigenici sono positivi si ha la certezza che il cane è affetto da FCP con presenza di macrofilarie;
- solo una diagnosi certa, con il supporto di indagini strumentali, consente al clinico di valutare la gravità e la classe di appartenenza del soggetto in esame;
- la diagnosi precoce di FCP è un presupposto irrinunciabile
per contenere i rischi connessi alla presenza del parassita, tenendo
conto anche delle problematiche legate alla terapia macro e microfilaricida,
soprattutto nel caso di infestazioni massive.
6.3. Validità di alcuni metodi ematologici e dell'ELISA
Nel 1996, Martini e colleghi effettuarono un'indagine sulla presenza
di D. immitis in 175 cani, provenienti dalla provincia di Padova, per
stabilire le performance di alcune tecniche diagnostiche.
I campioni di sangue, prelevati dai cani, furono esaminati per la ricerca
delle microfilarie con 5 metodi diagnostici ematologici quali filtrazione
(FI), striscio diretto (DS), Knott modificato (MK), sangue coagulato (CB)
e tubo capillare (CT). Per rilevare gli antigeni dei parassiti adulti
furono utilizzati 3 kit ELISA, quali PetChek (PE), Diasystems (DI), Uni-Tec
(UN).
Le performance dei test utilizzati furono valutate in termini di sensibilità
(SE), specificità (SP), precisione (AC), valore predittivo positivo
(PPV) e valore predittivo negativo (NPV) (Courtney e Cornell, 1990), tenendo
in considerazione anche gli aspetti economici e pratici. La performance
può essere influenzata da diversi fattori quali il momento dell'infestazione,
il tipo di infestazione (occulta, evidente, presenza di entrambi i sessi
del parassita o solo uno), la presenza di D. repens e/o Dipetalonema spp.,
il numero dei nematodi e i possibili trattamenti terapeutici o di profilassi
effettuati (Martini et al., 1996).
I risultati ottenuti dalle tecniche ematologiche furono confrontati con
lo stato d'infestazione rilevato alla necroscopia, esaminando il cuore,
le arterie polmonari, la vena cava e i polmoni. Alla necroscopia fu individuata
una prevalenza del 63%.
In tutte le prove fu osservata una correlazione positiva tra il numero
dei parassiti presenti negli ospiti e la sensibilità, la quale
variava dal 60% del tubo capillare all'81% del Dyasystems, mentre la specificità
dal 88% della filtrazione al 98% del Petchek.
Il valore di precisione ricavato dai test ELISA, in tutti circa dell'80%,
risultò essere più alto rispetto a quello dei test ematologici,
dei quali la tecnica di filtrazione presentava la performance migliore
(78.3%).
I valori di VPP presentarono un range dal 90.9% (FI) al 98.8% (PE). Il
più basso valore di VPN (58,9%) fu trovato con il tubo capillare,
mentre il più alto valore di VPN (76.3%) si ottenne con UN.
Il 35% dei cani infestati aveva meno di 5 vermi adulti, questo comportava
un alto rischio di risultati falsi negativi, nonostante l'alta prevalenza.
Gli strumenti diagnostici devono avere un'alta SE che permetta di ottenere
alti valori di VPN e quindi un'alta probabilità di classificare
correttamente i risultati negativi come sani (Martini et al., 1996).
La tecnica ELISA presentava i più alti valori di SE e VPN, tuttavia
la probabilità di sbagliare la classificazione di un cane infestato
rimaneva abbastanza alta, circa del 25%, anche usando il DI o UN, che
sono i test più sensibili.
I test, con l'eccezione di DI e UN, non riuscirono a registrare alcune
infestazioni con più di 30 vermi adulti e quindi con possibili
manifestazioni cliniche, nonostante la correlazione positiva tra numero
di vermi e la SE in tutti i test.
Concentrando l'attenzione sulle infestazioni occulte, è stato notato
che il metodo ELISA era quello migliore per rilevare i casi con basso
numero di vermi rispetto a quelli ematologici.
È evidente che la proporzione di risultati falsi negativi, nelle
infestazioni data da parassiti di un unico sesso, non era più bassa
con il test sierologico rispetto a quella di altri metodi.
I casi falsi positivi, pochi, erano dovuti per quanto riguardava i test
sierologici alla persistenza di antigeni circolanti dopo la morte, naturale
o indotta, dei vermi adulti; mentre per i metodi ematologici, alla persistenza
di microfilariemia dopo la morte degli adulti, o nei cuccioli per una
trasmissione transplacentare (Mantovani e Jackson, 1966).
Nella situazione epidemiologica in esame, un risultato positivo di ognuno
dei test poteva essere interpretato come reale indicazione di infestazione
da D. immitis. Un risultato negativo richiedeva l'uso di più accurate
procedure, soprattutto in soggetti con segni clinici e in quelli altamente
esposti al rischio di infestazione. In questi casi un miglioramento del
valore predittivo della procedura diagnostica può essere ottenuto
con l'applicazione di un metodo ematologico come la filtrazione, usato
come test di screening.
6.4. Diagnosi di filariosi cardiopolmonare nel gatto
Nella diagnosi di FCP del gatto, sia le metodiche di ricerca delle microfilarie,
spesso assenti, sia i test per la ricerca degli antigeni hanno dimostrato
una sensibilità molto inferiore rispetto al cane (Dillon, 2000).
La ricerca delle microfilarie, pur consapevoli dello scarso significato
diagnostico di questo esame, deve essere eseguita per accertarsi se il
soggetto sia microfilariemico, evitando in tal modo effetti indesiderati
nel corso dell'evoluzione della malattia o della terapia di altri concomitanti
patologie. Per altro, il gatto è recettivo anche a D. repens (Manfredi,
1998).
Per i gatti sono disponibili test per la rilevazione di anticorpi specifici,
tramite ELISA, che utilizzano antigeni ricombinanti o estratti e purificati
da un numero uguale di parassiti maschi e femmine. Questi test vengono
usati per lo screening della FCP felina e possiedono scarsa o assente
reattività crociata in caso di infestazioni da parassiti dell'apparato
digerente. I test che rilevano gli anticorpi hanno una maggiore sensibilità
rispetto agli altri per gli antigeni, considerando che le larve di entrambi
i sessi sono in grado di indurre la risposta immunitaria dell'ospite.
Alcune larve immature non arrivano mai a diventare parassiti adulti, per
cui un test anticorpale positivo indica l'esposizione sia a larve migranti
sia ai parassiti adulti e non solo la presenza di questi ultimi e occorre
dunque che sia confermato da altre prove della sussistenza della patologia
prima di emettere una diagnosi definitiva. La concentrazione anticorpale
non sembra essere correlata al numero di parassiti, né è
in relazione con la gravità dei sintomi clinici o dei quadri radiografici
(McCall et al., 1995).
È stato ammesso sul mercato italiano un test per la rilevazione,
nel sangue intero, siero o plasma, degli anticorpi contro D. immitis.
Il test (HESKA, ATI) è basato su una metodica immunocromatografica
ed il dispositivo di reazione è in formato monouso. La specificità
e la sensibilità sono entrambe molto elevate (Venco et al., 1997).
su
|